《中国新药注册临床试验进展年度报告(2022年)》摘登(五)
临床试验基本特征信息分析
首次临床试验登记用时分析
根据临床试验默示许可日期(或BE备案日期)和申请人首次提交登记日期对试验登记用时进行分析,默示许可日期(或BE备案日期)在2022年内的共计2114项登记,其中受理号登记788项(37.3%),BE备案登记1326项(62.7%)。
受理号登记平均用时116天(1~328天),申请人可在2个月内完成登记并提交的占比不足50%,1个月以内完成登记并提交的占比仅为25.9%。
BE备案登记平均用时67天(1~221天),约93.4%的申请人可在2个月内完成登记并提交,其中1个月以内完成登记并提交的占比达79.1%。
启动临床试验用时分析
按受理号登记的新药临床试验统计,2022年已登记国内有效首例受试者知情同意书(ICF)日期且无相关登记号信息(即排除2022年以前已获批但在2022年新增试验等其他情形)的登记共846项。根据ICF日期和临床试验获批日期计算临床试验启动用时,时间范围为1天~207个月,平均值为48个月。
总体上,超半数试验(55.8%)可在6个月内启动受试者招募,相比2021年(51.4%)略有增加。从药物类型上看,化学药品和生物制品在6个月内启动受试者招募的比例明显超过中药,分别为56.7%和59.1%,中药1年内启动受试者招募的比例(21.2%)明显高于2021年(4.4%)。
结合临床试验机构所在地进一步分析,临床试验组长单位较多的省(区、市),其临床试验的启动用时仍较长,2022年的前5个省份,仅浙江省6个月内启动受试者招募的比例均超过70%。此外,山东、河北和黑龙江3省6个月内启动受试者招募的比例也超过70%。海南省和辽宁省在6个月内实现100%启动试验。
如仅对试验获批后当年启动受试者招募情况进行分析(如当年有多个相关受理号,以最早批准日期计算),2022年共计402项,启动时间范围为 1天~11个月,平均用时3.3个月,6个月内启动招募的比例为91.5%。与2021年相比,启动时间进一步缩短(2021年平均为3.8个月),6个月内启动招募的比例进一步提高(2021年为85.7%)。
数据监查委员会(DMC)建立情况分析
2022年以受理号登记的1974项新药临床试验中,建立数据监查委员会(DMC)的临床试验共计有294项(14.9%)。
从药物分类分析,生物制品建立DMC的比例最高,为52.7%(155/294);其次为化学药品,为45.6%(134/294)。
从试验分期分析,Ⅲ期临床试验建立DMC的比例最高,达56.5%;Ⅳ期临床试验最低,仅为0.7%;Ⅰ期和Ⅱ期临床试验建立DMC的比例基本一致,分别为15.3%和18.7%。
临床试验完成情况分析
2022 年以受理号登记的1974项新药临床试验中,当年完成(试验状态为“已完成”,且首例知情同意日期和试验完成日期均在2022年内)129项,均为国内试验,主要以Ⅰ期临床试验为主(94 项,72.9%)。按药物类别分析,化学药品完成最多(114项,88.4%),含2项Ⅲ期临床试验;生物制品完成14项。
根据国内试验完成日期和国内首例ICF日期对完成临床试验的用时进行分析,完成时间范围为11~258天(自然日),平均用时76.7天。
按试验分期分析完成时间,Ⅰ期临床试验平均用时最短,为71.9天;Ⅳ期临床试验平均用时最长,为244天。
根据暂停或终止试验日期分析,2022 年主动暂停9项(化学药品3项、生物制品4项、中药2项),主动终止16项(化学药品10项、生物制品5项、中药1项),生物制品责令暂停1项,暂停和终止原因主要有研发策略调整、临床获益有限、方案设计问题等。
2022年度上市创新药临床试验分析
根据国家药监局药品审评中心审批结论日期,按药品名称统计,2022年度共批准21个创新药(不含中药提取物和新增适应证品种),其中化学药品最多,共11个品种,占52.4%;生物制品和中药分别为6个和4个品种。按上市许可持有人性质统计,以国内持有人为主,占76.2%。
适应证分布
从总体看,2022年度批准的创新药中抗肿瘤药物最多,共7个品种(33.3%),其中化学药品最多,共4个品种;其次为抗病毒药物和皮肤及五官科药物,各2个品种。此外,中药精神神经、妇科、肾脏病和消化领域各批准1个品种。
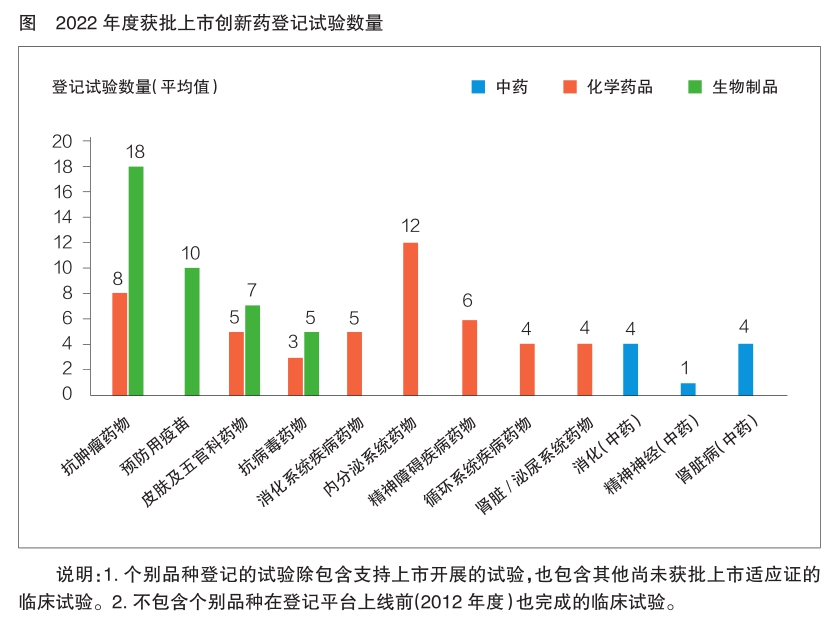
登记试验情况
按临床试验登记号(CTR)统计,2022年度获批上市创新药登记的临床试验数量范围为1~21 项,平均为7.3项。
从药物类型分析,生物制品登记临床试验数量最多,平均为11.6项;其次为化学药品,为6.5项;中药最少,仅为3项。
按适应证分析,登记临床试验数量平均超过10项的适应证领域依次为抗肿瘤药物、内分泌系统药物和预防用疫苗。
上市用时分析
根据品种境内首次获批临床试验日期和上市申请审批结论日期,分析2022年度获批上市创新药从获准开展临床试验至获准上市所用时间(不包含 2022年获批新增适应症品种和提取物)。
2022年度,获批创新药上市所用时间平均为7.6年。按药物类型分析,生物制品获批上市用时最短,平均为4.6年;其次为化学药品,平均为6.9年;中药用时最长,平均为15年。
2022年度获批上市创新药中,上市用时在5年内的品种共10个,占总体的47.6%;其中抗肿瘤药物4个,占总体的19.0%。
扫一扫在手机上查看当前页面