 |
2019年是药品监管法律建设史上具有里程碑意义的一年,新制定的《疫苗管理法》是世界首部综合性疫苗管理法律,新修订的《药品管理法》是近20年来的一次全面修订,《疫苗管理法》《药品管理法》将党中央、国务院的部署,人民群众的期盼,审评制度改革的经验,以法律的形式固定下来,为巩固和推进药品审评审批制度改革提供了有力的法律保障。这一年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)的坚强领导下,认真学习贯彻《药品管理法》《疫苗管理法》,持续推动药品审评审批制度改革,积极构建药品审评以流程为导向的科学管理体系,坚持依法依规、公开透明、服务为本、科学规范审评,切实保障药品安全有效可及,维护人民群众健康权益,成绩显著。
近期发布的《2019年度药品审评报告》,系统梳理了2019年我国新药申报及审评情况,全面展示了药审中心落实药品审评审批制度改革要求展开的工作和取得的成效。今日本报三、四版刊发该报告主要内容,以飨读者。
一、药品注册申请受理情况
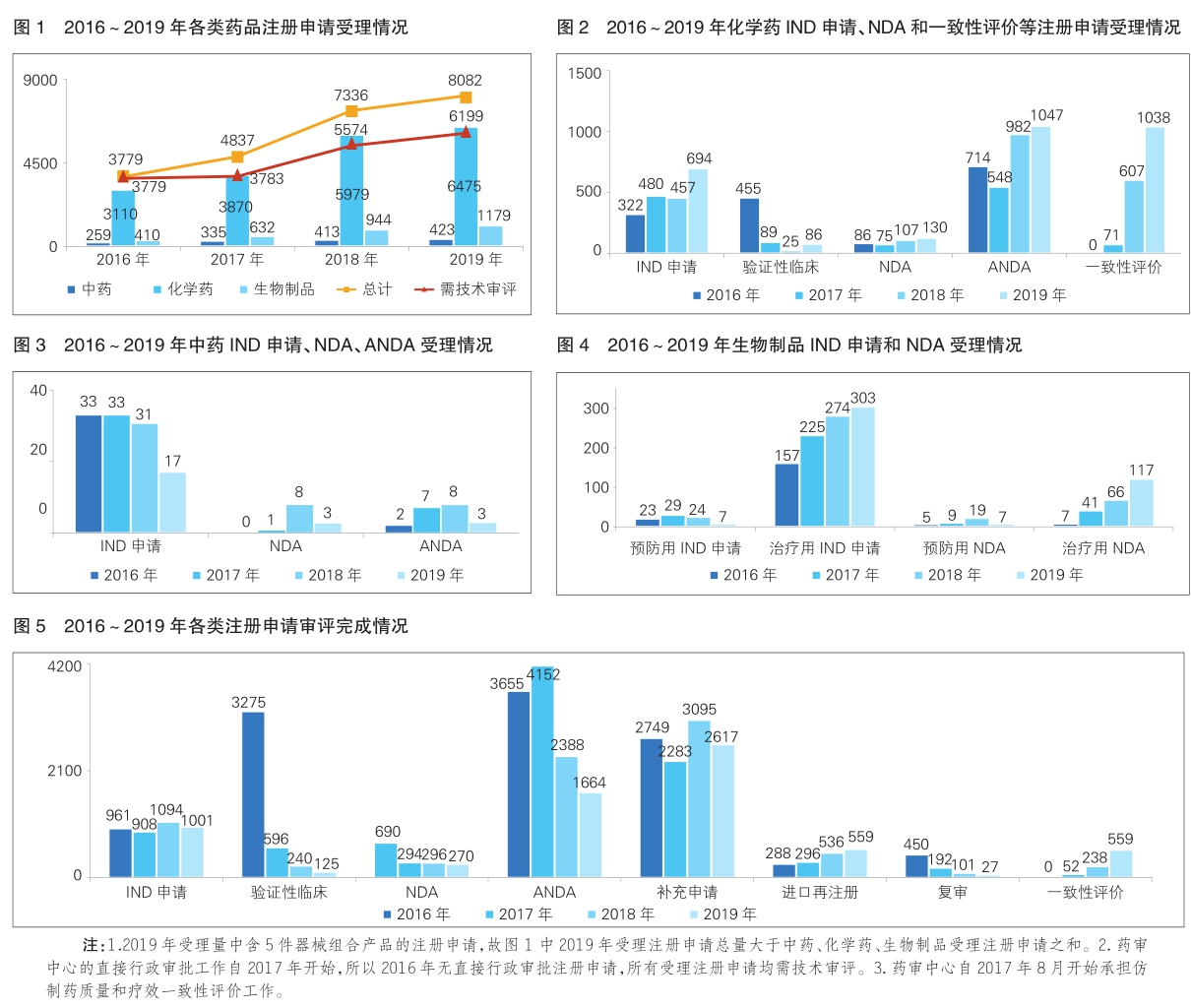
2019年,药审中心受理新注册申请8082件(含器械组合产品5件,以受理号计,下同)。其中,需技术审评的注册申请6199件(含4907件需药审中心技术审评和行政审批的注册申请),直接行政审批(无需技术审评,下同)的注册申请1878件。
(一)总体情况
药审中心受理的8077件药品注册申请中,化学药注册申请受理量为6475件,占2019年全部注册申请受理量的80.2%。2016~2019年各类药品注册申请受理情况详见图1。
2019年,受理需技术审评的注册申请6199件,较2018年增加11.21%。其中,化学药注册申请为4937件,较2018年增长了10.72%,占全部需技术审评的注册申请受理量的79.64%;中药注册申请257件,较2018年降低了14.33%;生物制品注册申请1005件,较2018年增长了23.3%。
药审中心受理1类创新药注册申请共700件(319个品种),(化学药的品种数以活性成分统计,中药和生物制品的品种数均以药品通用名称统计,下同),品种数较2018年增长了20.8%。其中,受理1类创新药的新药临床试验(IND)申请302个品种,较2018年增长了26.4%;受理1类创新药的新药上市申请(NDA)17个品种,较2018年减少了8个品种。
(二)国产创新药受理情况
药审中心受理国产1类创新药注册申请528件(244个品种)。其中,受理临床申请503件(228个品种),上市申请25件(16个品种)。按药品类型统计,化学药401件(144个品种),生物制品127件(100个品种),创新药的适应症主要集中在抗肿瘤、抗感染和消化系统疾病领域。
(三)进口创新药及原研药受理情况
药审中心受理5.1类化学药进口原研药注册申请157件(92个品种),受理1类进口创新药注册申请172件(75个品种),创新药的适应症主要集中在抗肿瘤、内分泌和神经系统疾病领域。
(四)各类注册申请受理情况
1.化学药注册申请受理情况
药审中心受理化学药注册申请6475件。其中,受理化学药IND申请694件,较2018年增长了51.9%;受理化学药NDA130件,较2018年增长了21.5%;受理仿制药上市申请(ANDA)1047件,较2018年增长了6.6%;受理仿制药质量和疗效一致性评价补充申请1038件(308个品种),件数较2018年增长71%。2016~2019年化学药IND申请、NDA和一致性评价等注册申请受理情况详见图2。
(1)国产、进口化学药IND申请、NDA受理情况
在化学药IND申请中,受理国产化学药IND申请444件,受理进口IND申请250件。国产化学药IND申请的适应症主要集中在抗肿瘤、消化系统和抗感染药物领域,进口IND申请的适应症主要集中在抗肿瘤、抗感染药物和神经系统领域。
化学药NDA中,受理国产化学药NDA45件,受理进口化学药NDA85件。国产化学药NDA的适应症主要集中在抗肿瘤和抗感染药物领域,进口化学药NDA的适应症主要集中在抗肿瘤和神经系统领域。
(2)1类化学药创新药受理情况
药审中心受理1类化学药创新药注册申请573件(219个品种),品种数较2018年增加了39.5%。其中,受理IND申请206个品种,较2018年增长了46.1%;受理NDA13个品种,较2018年减少了3个。
219个品种的1类化学药创新药注册申请中,国产化学药创新药注册申请为144个品种,进口化学药创新药注册申请为75个品种。
2.中药注册申请受理情况
药审中心受理中药注册申请423件。其中,受理中药IND申请17件,受理中药NDA3件,受理中药ANDA3件。2016~2019年中药IND申请、NDA和ANDA受理情况详见图3。
(1)中药IND申请受理情况
在17件中药IND申请(5、6、8类)中,适应症主要集中的治疗领域为消化、呼吸和骨科,占全部中药IND申请的76%。
(2)中药新药受理情况
药审中心受理5~6类中药新药注册申请18件(18个品种,无1~4类中药注册申请)。其中,中药IND申请15件(15个品种),中药NDA3件(3个品种),较2018年均有所减少。
3.生物制品注册申请受理情况
药审中心受理生物制品注册申请1179件。其中,受理生物制品IND申请310件(预防用IND申请7件,治疗用IND申请303件),较2018年增长了4%;受理生物制品NDA124件(预防用NDA7件,治疗用NDA117件),较2018年增长了45.9%。2016~2019年生物制品IND申请和NDA受理情况详见图4。
1类生物制品创新药受理情况:
药审中心受理1类生物制品创新药注册申请127件(100个品种),件数较2018年增长了3.3%。其中,预防用生物制品2件,治疗用生物制品125件。1类生物制品创新药注册申请中,IND申请121件(96个品种),较2018年增长了8%;NDA6件(4个品种,均为治疗用生物制品),较2018年减少了5件。
药审中心受理1类治疗用生物制品IND申请119件(95个品种),适应症主要集中在抗肿瘤治疗领域,占全部1类治疗用生物制品IND申请的69%。
二、药品注册申请审评审批情况
(一)总体完成情况
1.全年审评审批完成情况
2015年至2018年期间,药审中心通过扩充审评通道、强化审评项目管理、大规模招聘人员、借调省局人员等措施多渠道扩增审评力量、提高审评效率,使得药品注册申请积压基本得以解决,药审中心的工作重点已经由解决药品注册申请积压逐渐过渡为提升药品注册申请的按时限审评审批率,2019年药审中心实现了中药、化学药、生物制品各类注册申请按时限审评审批率超过90%,基本完成了国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)确定2018年实现按规定时限审批的工作目标。
2019年完成审评审批的注册申请共8730件(含器械组合产品5件)。其中,完成需技术审评的注册申请6817件(含4075件需药审中心技术审评和行政审批的注册申请),完成直接行政审批的注册申请1908件。2019年底在审评审批和等待审评审批的注册申请,已由2015年9月高峰时的近22000件降至4423件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),巩固了44号文件要求解决注册申请积压的改革成效。
2019年4423件在审评审批和等待审评审批的注册申请中,启动审评3334件,审评结束等待核查450件,处于暂停审评计时等待关联品种(290件)、等待申请人核对质标说明书包装标签工艺(235件)、等待检验报告(36件)等情况中的任务共639件。
完成技术审评的6817件注册申请中,中药注册申请300件,生物制品注册申请1104件,化学药注册申请5413件,化学药注册申请约占全部审评完成量的79%。
2.各类注册申请审评完成情况
药审中心完成IND申请审评1001件(含1件器械组合产品),完成NDA审评270件(含1件器械组合产品),完成ANDA审评1664件(含3件药械组合产品)。2016~2019年各类注册申请审评完成情况详见图5。
3.审评通过情况
2019年,药审中心审评通过批准IND申请926件,审评通过NDA164件,审评通过ANDA654件,审评通过批准口服固体制剂一致性评价申请260件(按活性成分统计95个品种,按通用名统计107个品种),品种数较2018年(57个品种)同比增长66.7%。
审评通过上市1类创新药10个品种,审评通过进口原研药58个品种(含新适应症)。
(二)化学药注册申请审评完成情况
1.总体情况
药审中心完成审评的化学药注册申请5413件。其中,完成化学药临床申请(IND申请和验证性临床)共746件,完成化学药NDA156件,完成化学药ANDA1655件。
2.审评通过情况
药审中心完成审评的化学药NDA共156件。其中,审评通过88件;完成审评的化学药IND申请621件,审评通过批准IND申请599件,其中批准1类化学药创新药IND申请493件(189个品种);批准IND申请的189个1类化学药创新药中,抗肿瘤药物、消化系统疾病药物、抗感染药物和神经系统疾病药物较多,占全部创新药临床试验批准数量的70%。
(三)中药注册申请审评完成情况
1.总体情况
药审中心完成审评的中药注册申请300件,其中完成IND申请17件,完成NDA3件,完成ANDA6件。
2.审评通过情况
药审中心审评通过批准中药IND申请15件,审评通过中药NDA2件(2个品种,芍麻止痉颗粒、小儿荆杏止咳颗粒)。
药审中心审评通过批准的中药IND申请15件,涉及10个适应症领域,其中心血管、消化、肿瘤、呼吸、肾脏各2件,共占67%。
(四)生物制品注册申请审评完成情况
1.总体情况
药审中心完成审评的生物制品注册申请共1104件,其中完成预防用生物制品IND申请(预防用IND申请)24件,完成治疗用生物制品IND申请(治疗用IND申请)338件,完成预防用生物制品NDA(预防用NDA)13件,完成治疗用生物制品NDA(治疗用NDA)95件,完成体外诊断试剂NDA(体外诊断NDA)2件。
2.审评通过情况
药审中心审评通过批准预防用IND申请18件、治疗用IND申请294件,审评通过预防用NDA5件、治疗用NDA67件、体外诊断NDA2件;审评通过批准生物制品IND申请312件;审评通过批准生物制品NDA74件。
(五)行政审批注册申请完成情况
1.总体情况
2019年,药审中心完成行政审批中药、化学药、生物制品注册申请5983件,其中完成审评审批的注册申请(临床试验申请、一致性评价、补充申请、进口药品再注册申请及复审)4075件,完成直接行政审批的注册申请(无需技术审评的补充申请、临时进口申请)1908件。
2.审评审批完成情况
4075件需药审中心审评审批的注册申请中,临床试验申请1124件(含验证性临床)、一致性评价345件、补充申请2127件、进口药品再注册申请471件、复审8件。按照临床试验60日默示许可制度,药审中心完成审评审批后发出临床试验通知书1178份,含1066份《临床试验通知书》和112份《暂停临床试验通知书》。因ANDA等注册申请在技术审评过程中需申请人补充临床试验,药审中心会以《临床试验通知书》的形式告知申请人,故临床试验通知书发出数量大于需药审中心审评审批的临床试验申请1124件。
3.直接行政审批完成情况
1908件药审中心技术审评的直接行政审批注册申请中,补充申请1491件、临时进口申请417件。
1908件药审中心直接行政审批注册申请平均审批时限为9.9个工作日,其中有1905件在法定的20日时限内完成,全年平均按时限完成率为99.8%。
(六)优先审评情况
1.优先审评品种纳入情况
根据原国家食品药品监督管理总局(以下简称原总局)《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管〔2016〕19号)和《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号),2019年药审中心将253件(按通用名计139个品种)注册申请纳入优先审评程序,同比降低19.2%,其中儿童用药和罕见病用药52件。
在已纳入优先审评的注册申请中,具有明显临床价值的新药占比34%,所占比例最大,其次为同步申报品种(28.1%)。与2018年已纳入优先审评注册申请的结构相比较,具有明显临床价值的新药占比由23%增至34%,按与原研药质量和疗效一致的标准完善后重新申报品种占比则由16.6%降至7.9%。从数据变化上来看,仿制药数量逐渐减少,优先审评资源更多地聚焦到具有明显临床价值、临床急需和临床优势的药品上来。
2.优先审评品种完成情况
2019年有143件注册申请(按通用名计82个品种)通过优先审评程序,得以加快批准上市,如我国自主研发的1类创新药注射用甲苯磺酸瑞马唑仑、甘露特钠胶囊,治疗罕见病法布雷病注射用阿加糖酶β,新型核因子κB受体激活因子配体(RANKL)抑制剂地舒单抗注射液,治疗糖尿病的聚乙二醇洛塞那肽注射液,治疗银屑病的本维莫德乳膏,非小细胞肺癌靶向治疗药物达可替尼片等药品。
(七)沟通交流情况
1.总体情况
为进一步强化服务意识,为申请人研发创新提供便捷的指导和服务,药审中心不断丰富沟通交流渠道,提高沟通交流效率和质量,形成了沟通交流会议、一般性技术问题咨询、电话咨询、邮件咨询和现场咨询等多渠道、多层次的沟通交流模式。
2019年药审中心接收沟通交流会议申请2633件,较2018年增长了32.8%;办理沟通交流会议申请1871件,较2018年增长了41.1%。药审中心为保证会议质量、提高会议效率,按照国家局《关于发布药品研发与技术审评沟通交流管理办法的公告》(2018年第74号)相关要求,在会前严格筛选,剔除了存在重复提交和未提供有效会议资料等问题的会议申请,经过审核的会议申请,按时限要求尽快召开沟通交流会议。对于无需召开会议的申请,药审中心均采用书面回复的形式及时反馈申请人。
2019年在网络平台接收一般性技术问题咨询16572个,较2018年增长了8.9%;接收电话咨询上万次、邮件咨询数千件,同时也面向社会提供现场咨询服务。
2.沟通交流会议申请的完成情况
在药审中心所办理的1871件沟通交流会议申请中,在药物研发关键阶段召开的Ⅱ类会议所占比例较大,为71.8%,而Ⅱ类会议中Pr e-IND会议申请占比最多,为34.9%。
沟通交流会议的形式为电话会议、视频会议、面对面会议。2019年召开了沟通交流会议421次,较2018年(322次)增长30.7%。
3.一般性技术问题答复情况
在药审中心网站上接收了社会公众16572个一般性技术问题的咨询。总体上,按照内容分类,公众咨询的问题主要集中于原辅包(4152个)、受理(1846个)等方面;按照药品分类,公众咨询的问题主要集中于化学药物(9743个),并且集中于化学药一致性评价(1386个)、化学药受理(1174个)等方面。
(八)核查检查情况
2019年,药审中心基于技术审评需要和申请人合规情况,启动核查任务1230个,其中药学现场核查任务782个,临床试验数据核查任务446个,药理毒理研究核查任务2个。
2019年,药审中心接收核查报告1242份,其中药学现场检查报告689份,临床试验核查报告551份,药理毒理研究核查报告2个。
此外,基于投诉举报和审评发现的问题,2019年药审中心启动有因检查12个,接收有因检查报告8份。
三、重点治疗领域品种
抗肿瘤药物:
1.甲磺酸氟马替尼片,为我国首个具有自主知识产权的小分子Bcr-abl酪氨酸激酶抑制剂,适用于治疗费城染色体阳性的慢性髓性白血病慢性期成人患者,本品获批上市为此类患者提供了更好的治疗选择。
2.达可替尼片,为第二代小分子表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI),适用于局部晚期或转移性表皮生长因子受体敏感突变的非小细胞肺癌患者的一线治疗。与第一代EGFR-TKI相比,本品可延长患者的生存期,为此类患者提供了更好的治疗手段。
3.甲苯磺酸尼拉帕利胶囊,为一种高选择性的多聚腺苷5'二磷酸核糖聚合酶(PARP)抑制剂创新药物,适用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗,本品获批上市为此类患者提供了新的治疗选择。
4.地舒单抗注射液,为核因子κB受体激活因子配体(RANKL)的全人化单克隆IgG2抗体,适用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤,属临床急需境外新药名单品种。本品获批上市填补了此类患者的治疗空白,满足其迫切的临床需求。
5.达雷妥尤单抗注射液,为全球首个抗CD38单克隆抗体,也是用于治疗多发性骨髓瘤的首个单克隆抗体,适用于治疗既往经过蛋白酶体抑制剂和免疫调节剂治疗后无药可选的多发性骨髓瘤,本品获批上市为此类患者带来了治疗获益。
6.利妥昔单抗注射液,为国内首个利妥昔单抗生物类似药注射液,同时也是国内首个上市的生物类似药,适用于治疗非霍奇金淋巴瘤,本品获批上市提高了此类患者的临床可及性。
7.贝伐珠单抗注射液,为国内首个贝伐珠单抗注射液生物类似药,适用于治疗转移性结直肠癌,晚期、转移性或复发性非小细胞肺癌,本品获批上市将提高该类药品的可及性。
抗感染药物:
8.格卡瑞韦哌仑他韦片,为全新的抗丙肝固定组合复方制剂,适用于治疗基因1、2、3、4、5或6型慢性丙型肝炎病毒(HCV)感染的无肝硬化或代偿期肝硬化成人和12岁至18岁青少年患者,属临床急需境外新药名单品种。本品针对全基因型在初治无肝硬化患者中的治疗周期可缩短至8周,其获批上市将进一步满足临床需求,为丙肝患者提供了更多治疗选择。
9.索磷韦伏片,为索磷布韦、维帕他韦、伏西瑞韦3种成分组成的固定复方制剂,适用于治疗慢性丙型肝炎病毒感染,属临床急需境外新药名单品种。本品可为全基因型既往直接抗病毒药物(DAA)治疗失败的丙肝患者提供高效且耐受的补救治疗方案,填补了临床空白。
10.拉米夫定替诺福韦片,为拉米夫定和替诺福韦二吡呋酯的固定剂量复方制剂,适用于治疗人类免疫缺陷病毒-1(HIV-1)感染,属国内首个仿制药。拉米夫定片和替诺福韦二吡呋酯片的联合治疗方案为临床抗HIV的一线治疗方案,本品获批上市可提高患者的用药依从性。
11.注射用头孢他啶阿维巴坦钠,为新型β-内酰胺酶抑制剂,适用于治疗复杂性腹腔内感染、医院获得性肺炎和呼吸机相关性肺炎,以及在治疗方案选择有限的成人患者中治疗由革兰阴性菌引起的感染。本品获批上市可解决日益突出的耐药菌感染所带来的巨大挑战,满足了迫切的临床治疗要求。
循环系统药物:
12.波生坦分散片,为我国首个用于儿童肺动脉高压(PAH)的特异性治疗药物,属儿童用药且为临床急需境外新药名单品种。PAH是一种进展性的危及生命的疾病,国内尚无针对儿童PAH患者的特异性治疗药物,本品为针对儿童开发的新剂型,其获批上市解决了儿童PAH患者的用药可及性。
风湿性疾病及免疫药物:
13.注射用贝利尤单抗,为一种重组的完全人源化IgG2λ单克隆抗体,适用于在常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的系统性红斑狼疮(SLE)成年患者,是全球近60年来首个上市用于治疗SLE的新药。目前SLE治疗选择不多,本品获批上市满足了SLE患者未被满足的临床需求。
14.阿达木单抗注射液,为国内首个阿达木单抗生物类似药,适用于治疗成年患者的类风湿关节炎、强直性脊柱炎和银屑病等自身免疫性疾病,本品获批上市将提高该类药物的临床可及性,有效降低患者经济负担。
神经系统药物:
15.拉考沙胺片,为新型抗癫痫药物,适用于16岁及以上癫痫患者部分性发作的联合治疗,属国内首个仿制药,本品获批上市提高了此类患者的用药可及性,方便患者使用。
16.咪达唑仑口颊粘膜溶液,为国内首家治疗儿童惊厥急性发作的口颊粘膜溶液,属儿童用药。小儿惊厥常为突然发作,静脉注射、肌肉注射、直肠给药等给药方式较为困难,口颊粘膜给药方式可弥补上述给药途径的不足,本品获批上市为此类患者提供了一项新的更便捷的给药方式。
镇痛药及麻醉科药物:
17.水合氯醛灌肠剂,适用于儿童检查/操作前的镇静、催眠,以及监护条件下的抗惊厥的中枢镇静药物,属首批鼓励研发申报儿童药品清单品种。本品是适合儿童应用的剂型,其获批上市填补了国内儿童诊疗镇静用水合氯醛制剂无上市品种的空白,满足我国儿科临床迫切需求。
皮肤及五官科药物:
18.本维莫德乳膏,为具有我国自主知识产权的全球首创治疗银屑病药物,具有全新结构和全新作用机制,适用于局部治疗成人轻至中度稳定性寻常型银屑病。本品获批上市为临床提供了一种新型的安全有效治疗药物选择。
19.司库奇尤单抗注射液,为我国首个白介素类治疗中至重度银屑病药物,属临床急需境外新药名单品种。与TNFα类药物相比,本品疗效更好,其获批上市为此类患者提供了一种新作用机制的药物选择。
罕见病药物:
20.依洛硫酸酯酶α注射液,为国内首个且唯一用于治疗罕见病IVA型黏多糖贮积症(MPSIVA,Mor quioA综合征)的酶替代治疗药物,属临床急需境外新药名单品种。黏多糖贮积症是严重危及生命且国内尚无有效治疗手段的疾病,本品获批上市填补了我国此类患者的用药空白。
21.注射用阿加糖酶β,为治疗罕见病法布雷病的长期酶替代疗法药物,属临床急需境外新药名单品种。法布雷病是严重危及生命且国内尚无有效治疗手段的疾病,已列入我国第一批罕见病目录,本品获批上市填补了国内此类患者的治疗空白。
22.诺西那生钠注射液,为国内首个且唯一用于治疗罕见病脊髓性肌萎缩症的药物,属临床急需境外新药名单品种。本品有效解决了我国脊髓性肌萎缩症目前尚无有效治疗手段的临床用药急需。
23.依达拉奉氯化钠注射液,适用于治疗罕见病肌萎缩侧索硬化(ALS),属临床急需境外新药名单品种。本品有效解决了目前我国ALS尚无有效治疗手段的临床用药急需。
预防用生物制品(疫苗):
24.13价肺炎球菌多糖结合疫苗,为具有自主知识产权的首个国产肺炎球菌结合疫苗,适用于6周龄至5岁(6周岁生日前)婴幼儿和儿童,预防1型、3型等13种血清型肺炎球菌引起的感染性疾病。本品是全球第二个预防婴幼儿和儿童肺炎的疫苗,其上市提高了该类疫苗的可及性,可更好地满足公众需求。
25.重组带状疱疹(CHO细胞)疫苗,适用于50岁及以上成人预防带状疱疹,属临床急需境外新药名单品种。随着年龄增长,带状疱疹患病风险升高,且其并发症严重影响患者正常工作和生活,目前国内缺少对该疾病的有效预防和治疗手段,本品获批上市进一步满足了公众特别是我国老龄患者的临床用药需求。
26.双价人乳头瘤病毒疫苗(大肠杆菌),为首个国产人乳头瘤病毒(HPV)疫苗,适用于9~45岁女性预防由HPV16/18引起的相关疾病,9~14岁女性也可以选择采用0、6月分别接种1剂次的免疫程序。本品可进一步缓解国内HPV疫苗的供需紧张,有助于满足我国女性对HPV疫苗的临床需求。
中药新药:
27.芍麻止痉颗粒,为白芍、天麻等11种药味组成的新中药复方制剂,属儿童用药,可治疗抽动-秽语综合征(Tour ette综合征)及慢性抽动障碍中医辨证属肝亢风动、痰火内扰者。本品可明显改善患儿的运动性抽动、发声性抽动,以及社会功能缺损,精神神经系统不良反应发生率明显低于已上市药品之一的阳性药盐酸硫必利片,为患儿尤其是轻中度患儿提供了一种更为安全有效的治疗选择,满足患者需求和解决临床可及性。
28.小儿荆杏止咳颗粒,为荆芥、苦杏仁等12种药味组成的新中药复方制剂,属儿童用药,具有“疏风散寒、宣肺清热、祛痰止咳”的功效,适用于治疗小儿外感风寒化热的轻度支气管炎。本品在咳嗽、咳痰等主要症状改善和中医证候、疾病愈显率等方面具有明显疗效,不良反应较少,为急性支气管炎小儿患者提供了一种新的安全有效的治疗选择。
四、重点工作进展情况
(一)加快临床急需境外新药审评
继续贯彻国务院常务会议精神,落实加快境外已上市临床急需新药审评要求,提高公众用药可及性,在确定了第一批48个品种名单的基础上,药审中心组织专家遴选临床急需新药品种,梳理确定第二批26个品种名单。对于列入临床急需境外新药名单的品种,逐一与相关企业进行沟通,主动向相关企业宣传国家加快临床急需境外新药审评审批相关政策,对于存在困难的企业给予指导并帮助其尽快提出注册申请,同时明确临床急需新药审评审批相关工作程序和资料要求,接受药品境外临床试验数据,设立专门审评通道,加快审评速度。
通过上述举措,2019年药审中心批准了16个用于治疗罕见病的、临床急需的药品,较2018年增长了60%,均在规定时限内完成审评工作,罕见病药品在3个月之内完成审评,其他临床急需药品在6个月之内完成审评,大大缩短了临床急需境外新药在我国上市的时间差距。目前已有26个品种批准上市或完成审评,14个品种正在进行技术审评,6个品种正在整理资料准备申报上市,11个品种正在整理资料且尚未提出注册申请,11个品种暂无申报上市计划,6个品种暂无法与持有企业取得联系。
(二)大力开展仿制药一致性评价
一是规范参比制剂遴选程序,制定并由国家局发布《仿制药参比制剂遴选与确定程序》,自开展参比制剂遴选工作以来发布了22批1899个品规(含注射剂参比制剂402个品规),2019年发布了3批748个品规;二是积极梳理国内特有品种情况,经专家论证和征求意见,在药审中心网站发布《国内特有品种评价建议》,指导企业开展评价工作;三是加强信息公开和沟通交流,在药审中心网站开通“仿制药一致性评价专栏”,及时公开通过一致性评价的品种说明书、企业研究报告及BE试验数据,举办一致性评价技术研讨班,做好相关政策和技术要求培训和宣讲,进一步加强与业界沟通交流,通过咨询日、申请人之窗、电话及公文等形式接受咨询,服务和指导企业申报;四是广泛调研,与专家和业界讨论,制定了《已上市化学注射剂一致性评价技术要求》《已上市化学注射剂一致性评价申报资料要求》《化学药品注射剂仿制药(特殊注射剂)质量和疗效一致性评价技术要求》,明确化学仿制药品注射剂一致性评价的整体研究思路和技术要求,以便企业能够更好地开展相关研究工作;五是2019年化学药生物等效性试验备案平台已收集442条信息,仿制药一致性评价生物等效性试验备案平台已收集737条信息。
(三)持续推动审评审批制度改革
1.落实临床试验期间风险管理
2019年新修订的《药品管理法》明确,“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制。”“药物临床试验期间,发现存在安全性问题或者其他风险的,临床试验申办者应当及时调整临床试验方案、暂停或者终止临床试验,并向国家药品监督管理部门报告。必要时,国家药品监督管理部门可以责令调整临床试验方案、暂停或者终止临床试验。”
2019年药审中心接收到来自164家国内外研发企业、涉及432个试验药物的临床试验期间可疑且非预期严重不良反应(SUSAR)个例报告117140份(涉及病例43131例),其中中国境内SUSAR个例报告为11062份(涉及病例3166例);自2019年4月26日开通了研发期间定期安全性更新报告(DSUR)的电子提交路径以来,已接收报告585份。
为更好地控制药物临床试验风险,药审中心开展了以下工作:一是强化临床试验期间安全性报告监测、审核、处理,逐步建立、厘清风险监测处理中各方的职责分工,规范相关工作机制和程序,有序开展药物临床试验期间风险管控工作。二是针对临床试验高风险药物(如CAR-T细胞治疗药物等)制定并实施重点监测方案。针对临床试验中存在的严重安全性风险的13个品种,提出了进一步的风险控制处理意见,积极与申请人进行风险沟通,通过督促申请人完善风险管理措施(例如修改临床试验方案、修改知情同意书、修改研究者手册、建议申请人主动暂停临床试验等),加强临床试验风险控制,切实保护受试者安全。
2.优化合规审查检查工作程序
一是优化完善合规审查体系,探索建立审评工作基于品种风险因素、合规工作基于申请人合规风险因素双向并行式的风险管控模式。二是推进研发生产主体合规信息库建设,推动审评与检查工作并联开展,将启动检查节点前移至专业审评阶段。三是持续强化审评与检查检验同步开展及工作衔接程序,推进检查检验协调工作电子化,建立审评与检查检验定期沟通交流机制。
3.实行原辅包与制剂共同审评审批
根据国家局《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年第56号,以下简称56号公告),药审中心对原料药登记受理系统和技术审评系统进行了完善,更新原料药登记表格和相关行政许可文书,实现了仿制境内已上市药品制剂所用的原料药通过登记系统提出单独审评审批。将符合56号公告有关要求的15538个原辅包产品推送至登记平台并标识为“A”。原辅包登记平台公示原料药、药用辅料和药包材共26424个,其中原料药12541个,药用辅料3066个,药包材10817个。
4.推进中国上市药品目录集工作
自开展《中国上市药品目录集》工作以来,《中国上市药品目录集》共纳入药品1055个(按品规计,下同),其中进口原研药品484个,通过仿制药质量和疗效一致性评价的药品336个,按化学药品新注册分类批准的仿制药105个,创新药21个,其他药品109个。2019年共收录了430个品规,较2018年(424个品规)同比增长1.42%。
(四)构建药品审评流程导向科学管理体系
按照国家市场监督管理总局和国家局工作部署,为不断完善和优化审评审批流程、提高审评效率,全面提升药品审评工作水平,药审中心秉承以人民为中心的发展理念,成立了科学管理体系领导小组和效能办公室,坚持全面研究、试点先行和边试边改的原则,以实地走访调研、全员参与、群策群力等多种途径,对现有流程进行分解细化、优化提升,提出各类有针对性的改革措施,积极开展药品审评流程导向科学管理体系建设工作。在做好顶层设计、研究试点督办的基础上,以制度建设、效能监督为有效手段,全方位确保各项改革措施落到实处。把内部监督机制融入审评权力运行的全流程,加强效能监察工作,将各项改革措施落到实处并取得初步成效。此项工作为提高审评效率、统一审评尺度、提高药品审评报告质量等起到了有力的保障作用。
(五)扎实推进审评科学基础建设
1.深度参与药品法律法规制修订
药审中心在积极参与《药品管理法》《疫苗管理法》等法律法规制修订工作的基础上,努力做好新修订的《药品注册管理办法》35个配套文件制修订工作。
2.积极推进ICH工作继续深入
全力推动我国药品审评审批体系与国际接轨,积极参与ICH国际协调和指导原则转化实施工作。一是深入参与ICH议题协调工作,向30个ICH工作组派出53名专家,参与ICH大会和管委会各类会议20场,组织ICH相关专家会议263场,处理ICH相关事项327件;二是重点推进ICH三级指导原则实施工作,评估ICH指导原则国内实施情况,协助国家局发布适用及推荐适用43个ICH三级指导原则公告,协调原文翻译相应指导原则;三是组织开展ICH培训相关工作,ICH工作办公室与ICH秘书处及第三方密切合作,开展ICH指导原则培训16场,培训对象多达2600人次,实现了对监管机构培训的目标,同时扩大了在业界的宣传和影响力。
3.强化细化审评技术标准体系建设
开展以指导原则为核心的审评标准体系建设,统一审评尺度,提升审评质量和效率,减少审评自由裁量权。2019年完成《晚期非小细胞肺癌临床试验终点技术指导原则》等33个指导原则发布和公开征求意见,其中9个指导原则的制定旨在推动中药传承与新药研发,例如《中药新药质量标准研究技术指导原则》。2019年经国家局发布或已报送国家局的指导原则8个。为了配合好《药品注册管理办法》的实施,药审中心启动了5个指导原则制修订工作,立足于鼓励创新、支持研发、规范审评,科学高效的指导原则体系逐步形成。
4.科学统筹审评质量管理体系建设
进一步推进药品审评和质量管理体系的结合和相互促进。将《质量手册》等体系文件与药品审评相关法规制度有机结合起来,让质量体系的各项要求能够贯彻落实到药审中心的各项工作当中去,一方面以质量目标为核心,科学运用信息系统工具,将审评监督管理工作日常化;另一方面以审评工作中发现的实际问题为导向,按照质量体系要求开展专项内部审核,高度重视国家局和申请人对药审中心审评业务的满意度和工作建议,及时制定改进措施并持续督促落实,提升质量管理体系在药品审评工作中的专业性,保证和提高药品审评质量和效率。
5.优化完善eCTD系统建设
加强审评信息化系统建设,全面推进药品电子通用技术文档资料管理系统(以下简称eCTD系统)建设工作。一是制定eCTD技术规范和申报指南等技术文件,明确申请人进行资料准备和提交注册申请的技术要求;二是完成与国内外10家制药企业之间的系统测试工作,优化系统功能和流程,为eCTD系统上线运行积累了实际操作经验;三是完成与eCTD项目相配套系统的改造和集成工作,实现了药品注册、受理、审评等全流程电子化管理;四是建设eCTD专栏,为加强与申请人的沟通交流提供优质的服务保障。
(六)持续提升审评队伍能力
扎实开展审评员培训工作,不断推进药审中心培训工作制度化、规范化、系统化、专业化,进一步完善审评员培训管理制度体系,制定药审中心《员工培训管理办法》等制度文件,在政治理论知识、廉政保密教育、利益防范、法律法规、审评相关专业理论知识、审评实务、实践操作、综合管理相关专业理论知识、综合素质能力方面,对员工开展岗前培训、继续教育、任职培训和在职学历学位教育,组织部分资深审评员、应届毕业生开展实践培训,全面拓展审评工作视野,持续提升审评能力,不断建设高素质的药品审评人才队伍。继续深化与世界卫生组织、美国食品药品管理局、丹麦药品管理局等国际组织和药监机构的沟通交流,加强与国内高校、科研院所的合作,开展学术互动与交流,紧跟行业发展前沿,服务产业创新发展。
五、2020年重点工作安排
2019年,药品审评工作取得了一定进展,但仍存在着一些问题:一是药审中心的人员结构和能力还不能满足药物研发创新的需要,实现审评能力的现代化仍是摆在审评队伍建设面前的艰巨任务;二是随着“两法一办法”的落地实施,大量的配套文件、系统等调整工作有待尽快完成,在更高审评标准的要求下,保障审评质量和效率需要付出更大的努力;三是审评信息公开力度、面对面沟通交流会议承接能力等与申请人的期盼仍有一定差距。
2020年药审中心将紧密围绕国家局工作部署,重点开展以下工作:一是积极推动规章制度体系完备;二是持续深化审评审批制度改革;三是不断完善药品审评保障机制;四是鼓励支持中医药传承创新发展;五是持续推进流程导向科学管理体系建设;六是坚持推进深化“放管服”改革;七是继续加强审评人才队伍建设。
苟日新,日日新,又日新。终日乾乾,与时偕行。药审中心以习近平新时代中国特色社会主义思想为指导,坚持以人民为中心的发展思想,全面落实“四个最严”要求,全面贯彻《药品管理法》《疫苗管理法》,持续深化药品审评审批制度改革,完善药物研发创新激励机制,激发创新力和竞争力,持续推动医药产业高质量发展,积极推进药品审评体系和药品审评能力现代化,努力建设具有国际影响力的、权威的、公众信赖的药品审评机构,加快新药好药上市,满足公众用药急需,保障公众用药权益,忠诚履行保护和促进公众健康的职责使命。
您好,欢迎访问本网站!您是本网站的第位访问者
版权所有:福建省商务厅
E-mail:admin@fiet.gov.cn 闽ICP备09008944号 地址:福州市鼓楼区铜盘路118号 邮编:350003
电话:(0591)87853616 传真:(0591)87856133
技术支持:福建拓尔通软件有限公司